データインテグリティ要求とトランステックのDI対応につきまして
 メーカー詳細
メーカー詳細
データインテグリティならトランステック


トランステックでの、データインテグリティへの対応についてガイドラインのご紹介と共にご説明させて頂きます。
詳細
詳細
1. データインテグリティの代表的なガイドライン
- 英国MHRA:「Guidance on GxP data integrity」https://www.gov.uk/government/publications/guidance-on-gxp-data-integrity
- FDA:「Data Integrity and Compliance With Drug CGMP Questions and Answers Guidance for Industry」https://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/default.htm
- PIC/S:「GOOD PRACTICES FOR DATA MANAGEMENT AND INTEGRITY IN REGULATED GMP/GDP ENVIRONMENTS」http://www.picscheme.org/layout/document.php?id=1566

2.データインテグリティの潮流とALCOA
トランステックでは製薬設備向けにシステム製品を開発しています。 設計に際しては最新の医薬関連の法規制、ガイドラインおよび業界団体の推奨や国際標準の基準を満たすことを前提としていますが将来、更に高いレベルが求められることを想定して仕様を設定します。 トランステックのシステム製品は現時点の要求だけでなく、将来の要求を見越して長期に亘って規制に対応できるよう設計されます。
さて、「データインテグリティ」の基本的な考えは、1997年にFDAが発表した“Part 11 of Title 21 of the Code of Federal 19 Regulations; Electronic Records; Electronic Signatures (21 CFR Part 11” (電子記録、電子署名に関する規則―いわゆるPar11)に基づいています。
当時、この規則を待ち望んでいたのは米国の製薬業界でした。これは自社の研究・開発ラボ、QCラボの分析機器が生成する膨大な電子データを申請に使いたいという強い要望があり、これに対してFDAが講じた、いわば規制緩和でした。
製薬分野でのPart11、データインテグリティの対応は先ず分析機器とそれらのデータを管理する「LIMS (Laboratory Information Management System) 」で先行しました。
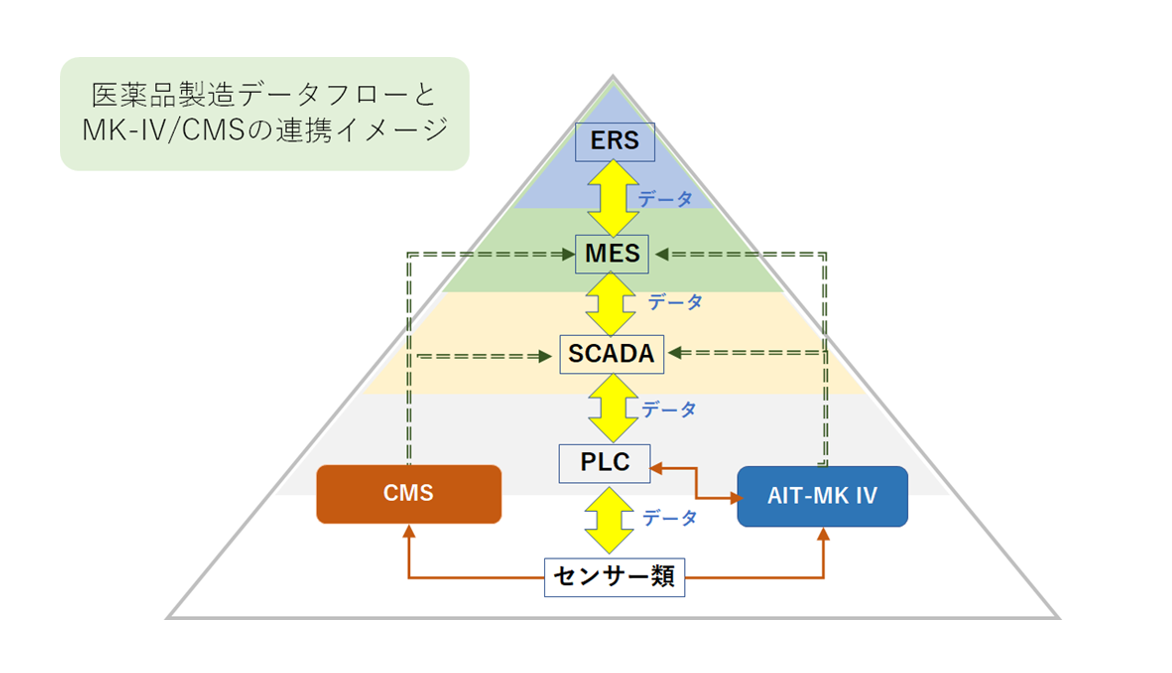
一方製造現場では多くの工程が自動化されたものの、現在の「ALCOA+」に基づく要件を満たすデータの電子化は立ち遅れていました。工場でよく見かけるのはMES(製造実行・管理システム)から作業指示書が紙で出力され、それを作業員がPLCに手入力する方法です。しかし最近の新設工場ではDI対応を前提とした設計となってきており、また既存の設備でも、SCADAを追加してMESからの作業指示をSCADA経由でPLCに命令するなどにシステム更新するなど、製造領域でもDI対応への動きが進んでいます。

3.トランステックでの対応
トランステックでは「CMS清浄度集中監視システム」および「AIT-MK IVろ過滅菌フィルター完全性試験制御システム」がデータインテグリティに対応しています。
これらシステムは先ずソフトウェアレベルでALCOA+を満たしています。
「AIT-MK IVろ過滅菌フィルター完全性試験制御システム」は、医薬品そのものの製造プロセスに組み込まれますので、顧客の工程制御PLCからの命令により動作が開始され、また、システムの設定情報や測定データはユーザーが指定するアドレスの顧客FTPサーバーに随時送信させることもできます。 このように連携する顧客システムと組み合わせてもデータインテグリティに対応するよう設計されています。
「AIT-MK IVろ過滅菌フィルター完全性試験制御システム」はこちらから
また、PHARM TECH JAPANに投稿させて頂いた「製薬向け自動コンピューターシステムに求められるデータインテグリティ要件」のリプリントをお渡ししています。お問合せはこちらからお願い致します。
 Transtechトランステック株式会社
Transtechトランステック株式会社
メーカーの詳細はこちら
